ФАРМАКОДИНАМИКА – раздел фармакологии, изучающий совокупность эффектов лекарственных средств и механизмы их действия. Лекарственные средства могут влиять на специфические рецепторы, ферменты, мембраны клеток или прямо взаимодействовать с веществами клеток.
ФАРМАКОДИНАМИКА – раздел фармакологии, изучающий совокупность эффектов лекарственных средств и механизмы их действия. Лекарственные средства могут влиять на специфические рецепторы, ферменты, мембраны клеток или прямо взаимодействовать с веществами клеток.Действие на специфические рецепторы. Рецепторы – макромолекулярные структуры, избирательно чувствительные к определенным химическим соединениям. Взаимодействие химических веществ с рецептором приводит к возникновению биохимических и физиологических изменений в организме, которые выражаются в том или ином клиническом эффекте.
Физико-химическое действие на мембраны клеток. Деятельность клеток нервной и мышечной систем зависит от потоков ионов, определяющих трансмембранный электрический потенциал. Некоторые лекарственные средства изменяют транспорт ионов. Так действуют антиаритмические, противосудорожные препараты, средства для общего наркоза.
Прямое химическое взаимодействие. Лекарственные средства могут непосредственно взаимодействовать с небольшими молекулами или ионами внутри клеток. Например, этилендиаминтетрауксусная кислота (ЭДТА) прочно связывает ионы свинца. Принцип прямого химического взаимодействия лежит в основе применения многих антидотов при отравлениях химическими веществами. Другим примером может служить нейтрализация хлористоводородной кислоты антацидными средствами.
ФАРМАКОКИНЕТИКА – раздел клинической фармакологии, предметом которого является изучение процессов всасывания, распределения, связывания с белками, биотрансформации и выведения лекарственных веществ.
Процессы, происходящие с лекарственными препаратами в организме, могут быть описаны с помощью ряда параметров.
Константа скорости абсорбции (Ка) характеризует скорость поступления препарата из места введения в кровь; константа скорости элиминации (Kel) – скорость исчезновения препарата из организма путем биотрансформации и выведения; константа скорости экскреции (Кех) – скорость выведения препарата с мочой, калом, слюной и другими путями.
Период полувыведения (Т1/2) – время, необходимое для уменьшения вдвое концентрации препарата в крови; зависит от константы скорости элиминации (Т1/2=0,693/Kel). Период полуабсорбции (T1/2a) – время, необходимое для всасывания половины дозы препарата из места введения в кровь; он пропорционален константе скорости абсорбции (T1/2a=0,693/Ka).
Кажущаяся начальная концентрация (С0) – концентрация препарата, которая была бы достигнута в плазме крови при внутривенном его введении и мгновенном распределении по органам и тканям.
Равновесная концентрация (Css) – концентрация препарата, которая установится в плазме (сыворотке) крови при поступлении препарата в организм с постоянной скоростью. При прерывистом введении (приеме) препарата через одинаковые промежутки времени в одинаковых дозах выделяют максимальную (Css max) и минимальную (Css min) равновесные коцентрации.
Объем распределения препарата (Vd) характеризует степень его захвата тканями из плазмы (сыворотки) крови. Vd (Vd = D/C0) – условный объем жидкости, в котором нужно растворить всю попавшую в организм дозу препарата (D), чтобы получилась концентрация, равная кажущейся начальной концентрации в сыворотке крови (С0).
Общий клиренс препарата (Clt) характеризует скорость “очищения” организма от лекарственного препарата. Выделяют почечный (Сlr) и внепочечный (Сler) клиренсы, которые отражают выведение лекарственного вещества соответственно с мочой и другими путями (прежде всего с желчью). Общий клиренс является суммой почечного и внепочечного клиренсов.
Площадь под кривой концентрация – время (AUC) – площадь фигуры, ограниченной фармакокинетической кривой и осями координат (AUC=C0/Kel). Величина (AUC) связана с другими фармакокинетическими параметрами – объемом распределения, общим клиренсом. При линейности кинетики препарата в организме величина AUC пропорциональна общему количеству (дозе) препарата, попавшего в системный кровоток. Часто определяют площадь под частью кривой (от нуля до некоторого времени t); этот параметр обозначают AUCt; например, AUC8 – площадь под кривой от 0 до 8 ч.
Абсолютная биодоступность (f) – часть дозы препарата (в процентах), которая достигла системного кровотока после внесосудистого введения; она равна отношению AUC после введения исследуемым методом (внутрь, в мышцу и др.) к AUC после внутривенного введения. Относительную биодоступность определяют для сравнения биодоступности двух лекарственных форм для внесосудистого введения. Она равна отношению (AUC'/AUC)*(D/D') после введения двух сравниваемых форм. Общая биодоступность – часть принятой внутрь дозы препарата, которая достигла системного кровотока в неизмененном виде и в виде метаболитов, образовавшихся в процессе всасывания в результате так называемого пресистемного метаболизма, или “эффекта первичного прохождения”.
Всасывание. Процесс поступления лекарственного вещества из места введения в кровь. Всасывание зависит от пути введения, растворимости лекарственного средства в тканях в месте его введения и кровотока в этих тканях. Естественно, что при внутривенном и внутриартериальном введении о всасывании говорить не приходится: лекарственное вещество сразу и полностью попадает в кровоток.
Распределение. После попадания в системный кровоток лекарственное вещество распределяется по различным тканям организма. Характер распределения зависит от растворимости лекарственного средства в липидах, степени связывания с белками плазмы крови, интенсивности регионарного кровотока и других факторов. Большая часть лекарственного вещества в первые минуты после всасывания попадает в те органы и ткани, которые наиболее активно кровоснабжаются, – сердце, печень, почки. Медленнее насыщаются лекарственным препаратом мышцы, слизистые оболочки, кожа и жировая ткань. Для достижения терапевтических концентраций лекарственных веществ в этих тканях требуется от нескольких минут до нескольких часов. Важным фактором, определяющим распределение лекарственного вещества, является скорость его диффузии в различные ткани. Легко и быстро происходит диффузия в интерстициальную ткань. Капилляры хорошо проницаемы и для водорастворимых, и для жирорастворимых веществ, поэтому водорастворимые препараты (например, стрептомицин), которые плохо всасываются из кишечника, вводят парентерально. Они хорошо проникают во внеклеточные области, но не оказывают действия на ЦНС и другие органы, попасть в которые вещество может, лишь преодолев мембранные барьеры. Растворимые в жирах препараты (например, газообразные анестетики) быстро распределяются по всему организму, одинаково хорошо проникая во внеклеточные и внутриклеточные области.
Многие лекарственные вещества обладают выраженным физико-химическим сродством к различным белкам плазмы крови, прежде всего к альбумину. Связывание лекарственных веществ с белками плазмы приводит к снижению их концентрации в тканях и месте действия, так как только свободный (несвязанный) препарат проходит через мембраны. Вещество, находящееся в комплексе с белком, лишено специфической активности. Свободная и связанная части лекарственного средства находятся в состоянии динамического равновесия. Клиническое значение имеют случаи, когда с белками крови связывается более 90% лекарственного вещества.
Биотрансформация. Под биотрансформацией, или метаболизмом, понимают комплекс физико-химических и биохимических превращений лекарственных средств, в процессе которых образуются полярные водорастворимые вещества (метаболиты), легче выводимые из организма. В большинстве случаев метаболиты лекарственных средств менее биологически активны и менее токсичны, чем исходные соединения. Однако биотрансформация некоторых веществ приводит к образованию метаболитов, более активных по сравнению с введенными в организм веществами.
Различают два типа реакций метаболизма лекарственных препаратов в организме: несинтетические и синтетические. Несинтетические реакции метаболизма лекарственных препаратов можно разделить на две группы: катализируемые ферментами эндоплазматического ретикулума (микросомальные) и катализируемые ферментами другой локализации (немикросомальные). К несинтетическим реакциям относятся окисление, восстановление и гидролиз. В основе синтетических реакций лежит конъюгация лекарственных средств с эндогенными субстратами (глюкуроновая кислота, сульфаты, глицин, глутатион, метильные группы и вода). Эти реакции происходят, если лекарственный препарат имеет такие функциональные группы, как гидроксильная, карбоксильная, аминная, эпоксидная. После завершения реакции молекула препарата становится более полярной и, следовательно, легче выводится из организма. На биотрансформацию лекарственных средств в организме влияют возраст, пол, окружающая среда, характер питания, заболевания и т.д.
Печень является основным органом метаболизма лекарственных веществ, поэтому любое ее патологическое состояние отражается на фармакокинетике препаратов. При циррозах печени нарушается не только функция гепатоцитов, но и ее кровообращение. При этом особенно изменяются фармакокинетика и биодоступность препаратов с высоким печеночным клиренсом. Увеличение биодоступности лекарственных средств с высоким печеночным клиренсом при пероральном применении больными циррозом печени объясняется, с одной стороны, снижением метаболизма, с другой – наличием портокавальных анастомозов, по которым препарат поступает в системное кровообращение, минуя печень. Метаболизм препаратов с высоким печеночным клиренсом, введенных внутривенно, снижен у больных циррозом печени, однако степень такого снижения различна. Колебание этого параметра зависит, скорее всего, от способности гепатоцитов метаболизировать лекарственные средства в зависимости от характера кровотока в печени.
Выведение лекарственных веществ из организма. Различают несколько путей выведения (экскреции) лекарственных веществ и их метаболитов из организма. К основным относят выведение с калом и мочой, меньшее значение имеет выведение с воздухом, потом, слюной и слезной жидкостью.
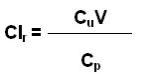
Выведение с мочой. Для оценки скорости выведения лекарственного вещества с мочой определяют его почечный клиренс (Сlr):
где Сu – концентрация вещества в моче и Сp – в плазме (мкг/мл или нг/мл), V – скорость мочеотделения (мл/мин).
Лекарственные препараты выводятся с мочой путем клубочковой фильтрации и канальцевой секреции. Большое значение имеет также их реабсорбция в канальцах почек. Кровь, попадающая в почки, фильтруется в клубочках. При этом лекарственные вещества проникают через стенку капилляров в просвет канальцев. Фильтруется только та часть препарата, которая находится в свободном состоянии. При прохождении через канальцы часть лекарственного вещества реабсорбируется и возвращается в плазму крови. Многие лекарственные вещества активно секретируются из капилляров и перитубулярной жидкости в просвет канальцев. При почечной недостаточности клубочковая фильтрация снижается и выведение различных препаратов нарушается, что приводит к увеличению их концентрации в крови. Дозу препаратов, которые выводятся с мочой, при прогрессировании уремии следует снизить. Канальцевая секреция органических кислот может быть блокирована пробенецидом, что приводит к увеличению периода их полувыведения. На выведение почками некоторых слабых кислот и оснований влияет рН мочи: первые быстрее выводятся при щелочной реакции мочи, а вторые – при кислой.
Выведение с желчью. Из печени лекарственные вещества в виде метаболитов либо в неизменном виде пассивно или с помощью активных транспортных систем поступают в желчь. В дальнейшем лекарственные препараты или их метаболиты выводятся из организма с калом. Под влиянием ферментов желудочно-кишечного тракта или бактериальной микрофлоры они могут превращаться в другие соединения, которые реабсорбируются и вновь доставляются в печень, где претерпевают новый цикл метаболических превращений. Подобный цикл носит название энтерогепатической циркуляции. На выведение лекарственных средств с желчью влияют молекулярная масса соединений, их химическая природа, состояние гепатоцитов и желчевыводящих путей, интенсивность связывания препаратов с клетками печени.
Выведение с молоком. Многие лекарственные вещества могут выводиться с грудным молоком. Как правило, концентрация лекарственных средств в молоке матери слишком мала для того, чтобы оказать действие на новорожденного. Однако в некоторых случаях количество поглощаемого с молоком лекарственного средства может представлять опасность для ребенка.
Реакция грудного молока несколько более кислая (рН 7), чем плазмы крови, поэтому вещества со свойствами слабых оснований, которые становятся более ионизированными при уменьшении рН, могут быть обнаружены в молоке в концентрациях, равных или превышающих таковые в плазме крови. Препараты, не являющиеся электролитами, легко проникают в молоко независимо от рН среды.
Сведений о безопасности для новорожденных многих лекарственных средств не имеется, поэтому фармакотерапию у кормящих женщин следует проводить крайне осторожно.
Биодоступность лекарственных средств. При внутрисосудистом введении лекарственное вещество полностью попадает в кровеносное русло. При пероральном, внутримышечном, подкожном введении оно должно пройти через ряд биологических мембран клеток (слизистой оболочки желудка, печени, мышц и т.д.), и только часть его попадает в системный кровоток. Действие препарата во многом зависит от того, насколько велика эта часть. Данный показатель характеризует биодоступность лекарственного средства. При внутривенном введении биодоступность равна 100%, при других путях введения (даже при внутримышечном и подкожном) она почти никогда не достигает 100%. На биодоступность лекарственного вещества влияют путь введения препарата, индивидуальные особенности организма больного, состояние желудочно-кишечного тракта, сердечно-сосудистой системы, печени, почек, а также биофармацевтические факторы (лекарственная форма, ее состав, особенности технологии производства препарата). Последние особенно важны в применении лекарственных средств внутрь (энтерально) в виде таблеток, капсул.
ФАРМАКОГЕНЕТИКА. Повседневная практика показывает, что эффективность и переносимость одних и тех же лекарственных средств у различных больных неодинаковы. Относительно недавно было установлено, что во многом эти различия определяются генетическими факторами, детерминирующими процессы метаболизма, рецепции, иммунного ответа и т.д.
Наследственные факторы, определяющие необычные реакции на лекарственные средства, в основном являются биохимическими. Чаще всего это недостаточность ферментов, катализирующих биотрансформацию препаратов. Атипичные реакции на лекарственные вещества могут наблюдаться также при наследственных нарушениях обмена веществ.
Синтез ферментов находится под строгим генетическим контролем. При мутации соответствующих генов возникают наследственные нарушения структуры и свойств ферментов – ферментопатии. В зависимости от характера мутации гена изменяется скорость синтеза фермента или синтезируется атипичный фермент.
Атипичная псевдохолинэстераза. Содержащийся в сыворотке крови и различных тканях фермент псевдохолинэстераза представляет собой гликопротеид с молекулярной массой около 300000. Небольшая продолжительность действия сукцинилхолина обусловлена тем, что под влиянием псевдохолинэстеразы он быстро гидролизуется и инактивируется. Однако у некоторых людей паралич мускулатуры и остановка дыхания длятся 2-3 ч и более в результате резкого снижения активности сывороточной псевдохолинэстеразы, которое вначале объясняли нарушением функции печени, где фермент синтезируется. Позднее было установлено, что снижение активности фермента обусловлено изменениями его аминокислотного состава.
Недостаточность глюкозо-6-фосфатдегидрогеназы. К числу распространенных наследственных дефектов относится недостаточность глюкозо-6-фосфатдегидрогеназы (Г-6-ФДГ). Носителями такого дефекта являются по крайней мере 200 млн. человек.
Г-6-ФДГ играет важную роль в обмене углеводов, в том числе в эритроцитах, где она катализирует окисление глюкозо-6-фосфата в 6-фосфоглюконат. В этой реакции образуется восстановленный никотинамидадениндинуклеотидфосфат (НАДФ•H2), который в дальнейшем используется для восстановления глутатиона (при участии глутатионредуктазы), а также частично метгемоглобина в гемоглобин. Восстановленный глутатион защищает гемоглобин и тиоловые ферменты, поддерживающие нормальную проницаемость мембран эритроцитов, от окислительного действия различных веществ, в том числе и лекарственных препаратов.
При недостаточности Г-6-ФДГ прием некоторых лекарственных средств ведет к массивному разрушению эритроцитов (гемолитические кризы) вследствие падения содержания в них восстановленного глутатиона и дестабилизации мембран (активность глутатионредуктазы остается нормальной).
Недостаточность ацетилтрансферазы. В основе индивидуальной чувствительности организма к изониазиду лежит неодинаковая интенсивность его метаболизма. Основным путем биотрансформации этого препарата является ацетилирование. Незначительная часть его гидролизуется, а также выводится с мочой в неизменном виде. Ацетилирование изониазида осуществляется при участии N-ацетилтрансферазы – фермента, содержащегося в печени человека. Активность этого фермента генетически обусловлена и у разных людей неодинакова. Было обнаружено, что после однократного приема изониазида у одних больных выделяется с мочой 6-7% введенного препарата в метаболизированной форме, у других – вдвое больше. У “медленных” инактиваторов концентрация изониазида в крови всегда значительно выше, чем у “быстрых”.
Недостаточность каталазы. Каталаза разрушает перекиси, образующиеся в организме, а также участвует в метаболизме этилового и метилового спирта. В результате реакции образуется огромное количество мелких пузырьков молекулярного кислорода. На этом основано применение растворов перекиси водорода в медицинской практике для обработки ран, язв и т.п. При нормальной активности каталазы образующиеся в организме, или экзогенные, перекиси не успевают окислять эндогенные вещества, в том числе гемоглобин.