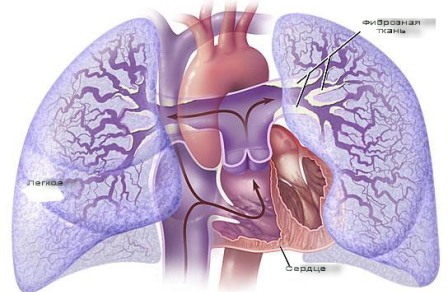
 ЛЕГОЧНАЯ ГИПЕРТЕНЗИЯ (ЛГ) – патологический синдром, в основе которого лежит повышение сопротивления в сосудистом русле легких или значительное увеличение объема легочного кровотока, сопровождающееся повышением давления в легочной артерии (ЛА) и перегрузкой правых отделов сердца. В норме давление в ЛА составляет: систолическое – 23-26 мм рт. ст., диастолическое – 7-9 мм рт. ст., среднее – 12-15 мм рт. ст. ЛГ – одно из основных прогностически неблагоприятных осложнений ряда болезней, в результате возникновения которого развивается декомпенсация кровообращения, плохо поддающаяся лечению известными методами. В зависимости от уровня сопротивления кровотоку в малом круге кровообращения (МКК) различают пре- и посткапиллярную формы ЛГ. В зависимости от времени возникновения выделяют острую ЛГ, развивающуюся за несколько часов, и хроническую, формирование которой происходит в течение нескольких недель, месяцев, лет.
ЛЕГОЧНАЯ ГИПЕРТЕНЗИЯ (ЛГ) – патологический синдром, в основе которого лежит повышение сопротивления в сосудистом русле легких или значительное увеличение объема легочного кровотока, сопровождающееся повышением давления в легочной артерии (ЛА) и перегрузкой правых отделов сердца. В норме давление в ЛА составляет: систолическое – 23-26 мм рт. ст., диастолическое – 7-9 мм рт. ст., среднее – 12-15 мм рт. ст. ЛГ – одно из основных прогностически неблагоприятных осложнений ряда болезней, в результате возникновения которого развивается декомпенсация кровообращения, плохо поддающаяся лечению известными методами. В зависимости от уровня сопротивления кровотоку в малом круге кровообращения (МКК) различают пре- и посткапиллярную формы ЛГ. В зависимости от времени возникновения выделяют острую ЛГ, развивающуюся за несколько часов, и хроническую, формирование которой происходит в течение нескольких недель, месяцев, лет.Причинами острой ЛГ могут быть тромбоэмболия или тромбоз в системе легочной артерии, острая левожелудочковая недостаточность различной этиологии (острый инфаркт миокарда, гипертонический криз и т.д.), бронхоастматический статус, воздействие лекарственных средств.
Причины хронической ЛГ:
1. Увеличение легочного кровотока:
- дефект межпредсердной перегородки (ДМПП);
- дефект межжелудочковой перегородки (ДМЖП);
- открытый артериальный проток (ОАП).
2. Увеличение давления в левом предсердии:
- болезни митрального клапана;
- миксома левого предсердия;
- левожелудочковая недостаточность.
3. Увеличение сосудистого сопротивления:
- гипоксического генеза – хронические обструктивные заболевания легких, рестриктивные болезни, высотная гипоксия, гиповентиляционный синдром;
- обструктивного генеза – рецидивирующая тромбоэмболия легочной артерии (ТЭЛА), первичная легочная гипертензия (ПЛГ), диффузные болезни соединительной ткани, веноокклюзивная болезнь, влияние лекарственных средств.
Патогенез ЛГ различен, и при каждой нозологической форме имеются ведущие причинно-следственные факторы. В настоящем разделе будут рассмотрены механизмы формирования ЛГ при основных болезнях сердечно-сосудистой системы (ЛГ при других заболеваниях см. соответствующие разделы).
Патологическая анатомия. При хронической ЛГ диаметр ствола ЛА и крупных ветвей увеличен, а толщина их стенок значительно превышает таковую у здоровых лиц. Достоверным признаком ЛГ являются атеросклеротические бляшки в интиме ветвей ЛА. Обязательным симптомом как пре-, так и посткапиллярной ЛГ служит гипертрофия всех мышечных слоев стенки ЛА. При этом гипертрофированные мышечные волокна раздвигают эластические, а коллагеновые волокна гиалинизируются и утолщаются. Изменениям подвергаются и бронхиальные артерии, которые превращаются в сосуды замыкающего типа, вследствие чего уменьшается приток крови из аорты. Для посткапиллярной ЛГ, в отличие от прекапиллярной, характерны выраженная гипертрофия мышечных элементов стенки мелких вен, склероз их интимы, происходит так называемая артериализация вен. Одним из косвенных, но устойчивых морфологических признаков посткапиллярной ЛГ считаются сетчатый лимфогенный пневмосклероз, гемосидероз и бурая индурация легких. Гемосидероз более выражен в верхних зонах легких, что отражает характер нарушений гемодинамики. ЛГ всегда сопровождается гипертрофией и дилатацией правых отделов сердца, выраженность которых зависит как от величины ЛГ, ее давности, так и от сопутствующих болезней сердца, легких. Наибольшей степени гипертрофия миокарда правого желудочка достигает при ПЛГ.
Клиническая картина. В большинстве случаев начальные признаки ЛГ при заболеваниях сердечно-сосудистой системы, вызвавших ее, скрыты проявлениями самой болезни. Симптомы острой или начальные признаки хронической ЛГ исчезают либо становятся менее выраженными при улучшении или полной коррекции внутрикардиальной и легочной гемодинамики. Клиническими признаками ЛГ могут быть одышка, доходящая до степени удушья, малопродуктивный кашель, кровохарканье как следствие нарушенной легочной гемодинамики и цианоз, свидетельствующий об артериальной гипоксемии. На ЛГ указывает акцент II тона на ЛА, эпигастральная пульсация вследствие перегрузки, гипертрофии и позиционных изменений правых отделов сердца, систолический шум над мечевидным отростком грудины, обусловленный относительной трикуспидальной недостаточностью.
При полипозиционном рентгенологическом исследовании отмечаются выбухание ствола ЛА и увеличение правых отделов сердца. Критерием ЛГ считают диаметр легочного ствола более 15 мм в прямой проекции.
Диагноз. Для диагностики ЛГ важны электро- и эхокардиографические признаки перегрузки правых отделов сердца или прямые признаки их гипертрофии. По характеру рентгенологических изменений легких можно уточнить форму ЛГ: для посткапиллярной характерен венозный застой, гиперволемической – усиление легочного рисунка (за счет артериального русла), степень которого зависит от объема сброса крови слева направо; при выраженной прекапиллярной ЛГ определяются симптом “обрубленных” корней, обеднение легочного сосудистого рисунка.
В практической медицине для диагностики ЛГ может быть рекомендована реография легочной артерии. Однако наиболее точным и информативным способом диагностики ЛГ, а также установления причин ее возникновения является катетеризация правых отделов сердца, дополненная при необходимости ангиопульмонографией.
Легочная гипертензия при врожденных пороках сердца. Увеличение легочного кровотока является пусковым механизмом в развитии ЛГ при таких врожденных пороках, как ДМПП, ДМЖП, ОАП. Подобную ЛГ называют гиперволемической. Величина давления в ЛА при этом зависит от соотношения величин легочного кровотока и легочного сосудистого сопротивления. Патологический внутрисердечный или межсосудистый сброс крови слева направо приводит к гиперволемии с объемной перегрузкой МКК. В начальной стадии ЛГ имеет преимущественно функциональный характер, т.е. она обратима при своевременной коррекции порока и нормализации гемодинамики. Давление в ЛА значительно повышается в более поздних стадиях болезни (через несколько, иногда 20-30 лет) при развитии морфологических изменений в сосудистой стенке легочных артерий и артериол в виде склероза, фиброэластоза интимы, приводящих к сужению просвета сосудов. При этом выраженность морфологических изменений, т.е. органического, необратимого фактора, может быть настолько велика, что коррекция порока не приводит к снижению давления в ЛА до нормального уровня.
Легочная гипертензия при увеличении давления в левом предсердии. Существует ряд заболеваний, при которых причиной возникновения ЛГ становится увеличение давления в левом предсердии. Подобная ЛГ носит название “посткапиллярная” (пассивная, венозная).
Одной из наиболее частых причин возникновения “левопредсердной” ЛГ считают митральный стеноз. Клинически значимые нарушения гемодинамики в МКК появляются при площади левого предсердно-желудочкового отверстия менее 2 см2, что сопровождается повышением давления в левом предсердии до 25-30 мм рт. ст. Миокардиальные сфинктеры, охватывающие легочные вены и предотвращающие регургитацию крови в легочные вены, ослабевают, создавая условия для заброса крови из левого предсердия в легочные вены. Сначала повышается давление в легочных венах, капиллярах, а затем – в сосудах ЛА. Подобная ЛГ не превышает 50-60 мм рт. ст. При дальнейшем повышении давления в левом предсердии и легочных венах возникает рефлекторный спазм легочных артериол и мелких артерий, давление в ЛА резко возрастает, достигая в ряде случаев величины давления в большом круге кровообращения и даже превышая его нормальные цифры, т.е. формируется активная, прекапиллярная ЛГ.
Аналогичные нарушения гемодинамики в МКК возникают и при миксоме левого предсердия – доброкачественной опухоли сердца. Достигая определенных размеров, опухоль опускается на митральное отверстие, иногда пролабируя в него, создавая так называемый функциональный митральный стеноз.
ЛГ при “чистой” митральной недостаточности органического характера (при ревматизме, инфекционном эндокардите) менее выражена, чем при митральном стенозе, так как отсутствует препятствие оттоку крови из левого предсердия в левый желудочек.
Митральная недостаточность функционального характера – частый симптом многих заболеваний сердца, осложняющихся поражением миокарда левого желудочка, его систолической и диастолической перегрузкой: ИБС, гипертонической болезни, миокардитов, кардиомиопатий, миокардиодистрофий, пороков аортального клапана. Дилатация левого желудочка приводит к растяжению предсердно-желудочкового клапанного кольца, создавая условия для обратного тока (регургитации) крови в левое предсердие. ЛГ при этом, как правило, не бывает высокой (до 50-60 мм рт. ст.).
Легочная гипертензия вследствие тромбоэмболии легочной артерии. Возникающая при этом ЛГ – прекапиллярная, обусловленная механическим закрытием просвета одного или нескольких сосудов легочной артерии и генерализованной вазоконстрикцией со значительным возрастанием сопротивления. Часто именно вазоконстрикция определяет степень повышения давления в ЛА и исход тромбоэмболии. В результате рецидивов ТЭЛА возникает хроническая постэмболическая легочная гипертензия (ХПЭЛГ).
Среди факторов, предрасполагающих к развитию ТЭЛА, на первом месте стоят тромбоз вен нижних конечностей и малого таза, беременность, злокачественные новообразования, оперативные вмешательства, после которых требуется длительное пребывание больного в постели (“болезнь прикованных к постели”).
Причиной тромбоэмболии могут быть тромботические массы при внутриполостных опухолях правых отделов сердца, выраженных нарушениях сердечного ритма, особенно мерцательной аритмии, вегетации с пораженного эндокардитом трикуспидального клапана.
Следует различать ТЭЛА и первичный тромбоз в системе ЛА, который обычно развивается при застое в малом круге кровообращения, обусловленном тяжелыми заболеваниями легких и сердца. Как правило, это тромбоз мелких ветвей ЛА, чаще – двусторонний.
Основными причинами тромбообразования как в венозной системе большого круга кровообращения, так и в сосудах МКК могут быть нарушение кровотока, изменения свертывающей системы крови, местное повреждение сосудистой стенки. Главными условиями отрыва тромба являются ускорение кровотока и повышение венозного давления при натуживании, сильном кашле, резком изменении положения тела. Тромбоэмбол может обтурировать один из крупных сосудов ЛА, однако возможна фрагментация эмбола на более мелкие с обтурацией сосудов малого калибра. Нарушение кровотока компенсируется за счет анастомозов между легочными и бронхиальными артериями, артериями и венами, минуя капилляры. Шунтирование неоксигенированной крови и перестройка вентиляции в связи с изменением кровотока вызывают артериальную гипоксемию.
При массивной и субмассивной ТЭЛА повышается центральное венозное давление, развиваются признаки острой ЛГ с перегрузкой правых отделов сердца, уменьшается сердечный выброс, снижается системное артериальное давление, нередка ишемия миокарда вследствие снижения давления в аорте, несоответствия коронарного кровоснабжения потребностям миокарда в кислороде.
Выделяют несколько форм ТЭЛА. При массивной ТЭЛА смерть наступает через несколько минут от асфиксии или остановки сердца. Для острой формы характерны внезапное начало, ангинозные боли, коллапс; смертность в течение 1-х суток очень высокая. Подострая ТЭЛА заканчивается инфарктом легкого; при своевременном установлении диагноза и адекватной терапии прогноз благоприятный. Нередки стертые, клинически неманифестирующие ТЭЛА, часто недиагностируемые или оцениваемые как пневмония. Исходом подобных повторяющихся тромбоэмболии может стать ХПЭЛГ.
Клиническая картина ТЭЛА чрезвычайно разнообразна. Одним из постоянных признаков болезни является внезапно возникшая или усилившаяся одышка инспираторного либо смешанного характера. Отмечается цианоз кожи лица, шеи, груди – от умеренного до “чугунного”. При системной гипотензии этот признак исчезает. Проявлением острой коронарной недостаточности могут быть загрудинные ангинозные боли. Изменения системной гемодинамики нередко проявляются преимущественным нарушением церебрального, почечного или мезентериального кровообращения, создавая дополнительные сложности при диагностике.
Обязательным признаком ТЭЛА считается синдром ЛГ с перегрузкой правых отделов сердца. Клинически он проявляется тахикардией более 100 в 1 мин, ритмом галопа, систолическим шумом у основания мечевидного отростка вследствие относительной трикуспидальной недостаточности, усилением II тона на ЛА, пульсацией яремных вен, увеличением печени и болезненностью из-за перерастяжения ее капсулы.
Электрокардиографические признаки перегрузки правых отделов сердца в 25-30% случаев могут отсутствовать, чаще других находят следующие: сдвиг переходной зоны влево, Р-pulmonale, SI-QIII, инверсия зубца Т в V2-V3, остро возникшая блокада правой ножки пучка Гиса (полная или неполная).
В 10-25% случаев ТЭЛА осложняется инфарктом легкого, что клинически проявляется легочно-плевральным синдромом на 2-5-й день болезни. Для него характерны повышение температуры тела, боли в груди, усиливающиеся при дыхании, кровохарканье, шум трения плевры, иктеричность склер вследствие распада гемоглобина в очаге инфаркта, физикальные симптомы инфильтрации перифокально расположенных участков легких. Клинические данные дополняются результатами рентгенологического исследования, при котором выявляют повышение прозрачности легочной ткани соответственно эмболизированному сосуду вследствие обеднения сосудистого рисунка, значительное расширение участка легочной артерии проксимальное эмбола, выбухание II дуги по левому контуру сердца, пульсация корней легких, патологические тени перифокально расположенных инфарктов легких, плевральный выпот, высокое стояние купола диафрагмы и ограничение ее экскурсии.
Диагностика. Высокоинформативным методом выявления ТЭЛА, а также верификации диагноза ХПЭЛГ является перфузионное сканирование легких с технецием. На сканограммах видны очаги неравномерного распределения изотопа с “немыми” зонами дистальнее эмболизированных сосудов. При отрицательном результате исследования ТЭЛА можно исключить. При сомнительных данных показана полипозиционная ангиопульмонография.
Лечение. Хирургическое лечение показано при массивной тромбоэмболии ствола и главных ветвей ЛА. Выполняют прямую эмболэктомию в условиях искусственного кровообращения или при окклюзии полых вен. Консервативное лечение включает антикоагулянты (гепарин 20 000-30 000 ед. внутривенно капельно со скоростью 16-20 капель в 1 мин в течение 2-3 дней, затем подкожно – 5000 ед. 4 раза в день в течение 10-20 дней, в дальнейшем больные длительно получают антикоагулянты непрямого действия под контролем протромбинового индекса); тромболитические препараты (стрептаза 250 000-500 000 ед. внутривенно струйно, затем 75 000-100 000 ед/ч в течение 18-72 ч или фибринолизин 20 000-40 000 ед. внутривенно со скоростью 16-20 капель в 1 мин 2-3 дня; суточная доза фибринолизина может быть увеличена до 80 000-100 000 ед.). Назначают также реополиглюкин, обезболивающие препараты, антибиотики, противокашлевые средства, периферические вазодилататоры (нитраты длительного действия, препараты группы нифедипина), проводят постоянную малопоточную оксигенотерапию. В дальнейшем с целью профилактики рецидивов ТЭЛА, помимо проведения терапии непрямыми антикоагулянтами, важно выявить источник эмболизации (венография). Хирургическое лечение, проводимое с целью профилактики рецидивов, предполагает парциальную окклюзию или перевязку нижней полой вены с наложением коллатералей, а также установку зонтичного фильтра.
Первичная легочная гипертензия (ПЛГ) – заболевание, признанное Комитетом экспертов ВОЗ (1976) самостоятельной нозологической формой. В основе его лежат специфические морфологические изменения в виде плексогенной легочной артериолопатии, не встречающейся ни при какой другой форме ЛГ: концентрический фиброз и некроз стенок ЛА диаметром 100-1000 мкм, а также своеобразные анастомозы. Согласно современным требованиям, для установления диагноза ПЛГ необходимы наличие высокой ЛГ, отсутствие известных заболеваний сердца и сосудов, которые осложняются ЛГ, отсутствие локальных аномалий легочных сосудов, устанавливаемое при ангиопульмонографии, исключение других причин ЛГ с помощью биопсии легких и нахождение характерных гистологических признаков ПЛГ. Выделяют врожденную и приобретенную формы ПЛГ.
Патогенез ПЛГ до конца не изучен. Наиболее вероятными следует признать два предположения: 1) генетически обусловленное несовершенство центральной регуляции сосудистого тонуса; 2) нарушения (врожденные или приобретенные) метаболизма вазоактивных веществ, в первую очередь серотонина. В дальнейшем к генерализованной вазоконстрикции сосудов легких присоединяются морфологические изменения по типу плексогенной легочной артериолопатии. ПЛГ чаще встречается в раннем детском возрасте и у молодых женщин. Характерны постепенно нарастающая одышка, уменьшение массы тела, быстрая утомляемость, кардиалгии, синкопальные состояния. Результаты клинико-инструментальных исследований указывают на ЛГ, как правило, высокую, превышающую в ряде случаев системное АД. Продолжительность жизни детей достигает 10 лет, взрослых – 3-5. Летальный исход наступает при прогрессировании правожелудочковой недостаточности и декомпенсации кровообращения, фатальной аритмии сердца.
Диагностика ПЛГ при жизни затруднена. Необходимым условием является исключение всех вторичных форм ЛГ.
Дифференциальная диагностика хронических форм ЛГ. Не вызывает особых сложностей диагностика ЛГ при хронических заболеваниях легких обструктивно-рестриктивного типа, протекающих с выраженной дыхательной недостаточностью. Характерная клиническая картина в сочетании с результатами инструментальных исследований (ЭКГ, эхоКГ, рентгенологическое исследование сердца и легких) позволяют достаточно убедительно диагностировать поражение левых отделов сердца, не прибегая к зондированию. Затруднения при оценке клинической картины могут возникнуть в поздних стадиях врожденных пороков сердца (ДМПП, ДМЖП) с обратным сбросом крови через дефект вследствие высокой ЛГ. Диагноз уточняют при катетеризации правых отделов сердца.
Наибольшие сложности представляет дифференциальная диагностика ХПЭЛГ и ПЛГ. В пользу ПЛГ свидетельствуют следующие признаки: внезапное появление одышки, хроническая венозная недостаточность и флебиты нижних конечностей, оперативные вмешательства на органах малого таза, длительное пребывание больного в постели, предшествующее появлению одышки, гиперкоагуляция. Диагноз подтверждают при сканировании легких или катетеризации правых отделов сердца.
Лечение ЛГ. Лечение синдромной ЛГ зависит от заболевания, вызвавшего ее. Своевременная диагностика врожденного порока сердца и его хирургическая коррекция могут полностью восстановить внутрикардиальную гемодинамику. Операция не показана в далеко зашедших случаях при выраженной ЛГ и необратимых морфологических изменениях сосудистой стенки легочных сосудов, о чем судят по результатам катетеризации правых отделов сердца.
При пороках митрального и аортального клапанов сердца органической природы методом выбора также является хирургическое лечение. Операция показана и при миксоме левого предсердия.
Консервативное лечение синдрома ЛГ, как и ПЛГ, состоит в назначении препаратов эуфиллина, желательно длительного действия, нитратов пролонгированного действия и антагонистов ионов кальция группы нифедипина в обычных терапевтических дозах в течение длительного периода времени. Показаны повторные курсы терапии ангиопротекторами (продектин, трентал и др.), дезагрегантами (курантил), метаболическими средствами. Лечение декомпенсации кровообращения проводят по общим принципам.